Mitä engrammit ovat?
Engrammit ovat aivoissa sijaitsevia hermosoluista koostuvia rakenteita, jotka tallentavat yksittäisten muistojen tietoja. Engrammit ovat muistojen offline-tallennusmuoto, mikä tarkoittaa, että ne ovat olemassa aivoissamme riippumatta siitä, muistammeko engrammien koodaamia muistoja kullakin hetkellä vai emme. Engrammien aktivoituminen johtaa niiden koodaamien muistojen mieleen palautumiseen. Jos siis jokin muisto, kuten muisto eilisestä aamupalastasi, ilmestyy yhtäkkiä mieleesi, tiedät, että aivoissasi aktivoitui kyseistä muistoa koodaava engrammi.
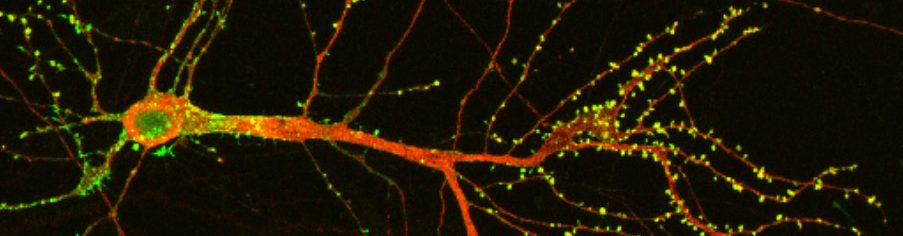
Yksittäiset engrammit koostuvat aivojen eri osiin jakautuneista hermosolujoukoista, joiden välisiin yhteyksiin muistojen tieto tallentuu. Nykyään ajatellaan, että aivojen eri alueilla sijaitsevat hermosolujoukot saattavat tallentaa muistojen eri komponentteja. Jos palataan aiemmin mainittuun aamupalaesimerkkiin, voisi tämä käytännössä tarkoittaa, että eilisen aamupalan näkötieto tallentuisi näköaivokuorella sijaitsevaan hermosolujoukkoon. Kahvin tuoksun tieto saattaisi taas tallentua hajuaistin tietoa käsittelevälle aivoalueille. Yhdessä nämä eri aivoalueille jakautuneet hermosolujoukot, eli engrammi, muodostaisivat muiston kokonaisuuden, jonka koemme muistoja muistellessamme.

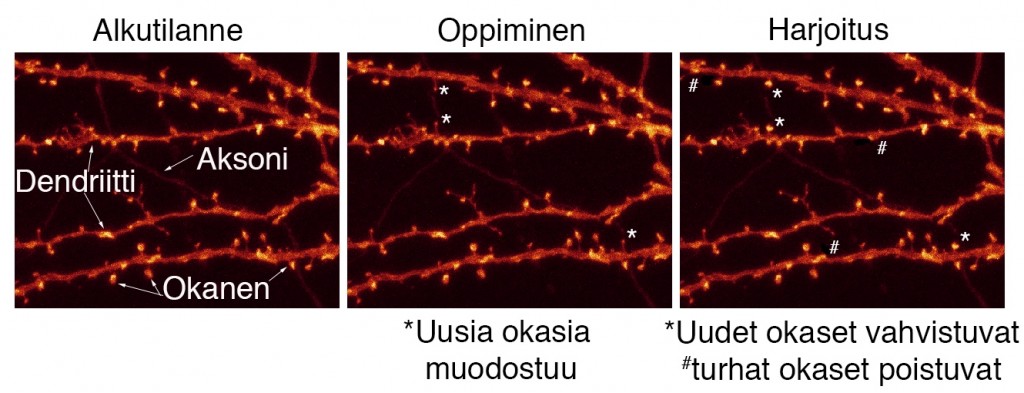
Kuva 1. Engrammit koostuvat eri aivoalueilla sijaitsevista hermosolujoukoista. Nykyään ajatellaan, että eri aivoalueilla sijaitsevat hermosolujoukot saattavat tallentaa muistojen eri komponentteja, kuten näköaistin ja hajuaistin tietoja. (Kuva: Purabi Deshpande, Research Matters)
On kuitenkin muistettava, että muistojen ja niiden komponenttien tallentaminen ja mieleen palauttaminen ei ole kirjastomaista. Kirjastomaisessa muistamisessa laittaisimme kaikki tiedot yhdestä muistosta kirjaan, veisimme tämän kirjan kirjastoon ja menisimme muistelun aikana kirjastoon hakemaan täsmälleen samaa kirjaa. Todellisuudessa muisti on paljon dynaamisempi, koska muistamisen aikana aivojen voidaan ajatella uudelleenrakentavan muisteltavia muistoja. Tähän prosessiin voivat vaikuttaa monet tekijät, kuten senhetkinen tunnetila tai aiemmat kokemukset. Näiden tekijöiden vuoksi muistojen luomisen tai niiden mieleen palauttamisen aikana voi tapahtua virheitä. Tällöin sen sijaan, että hakisit kirjastosta alkuperäistä kirjaa, saatat tietämättäsi hakea kirjan, jossa puolet sivuista ovat yhdestä kirjasta (eli engrammista) ja puolet toisesta.
Mitä engrammit ovat käytännössä? Kuten aiemmin mainittiin, engrammit ovat niitä hermorakenteita, jotka sisältävät yksittäisten muistojen tiedot. Engrammien aktivaatio saa aikaan niiden sisältämän muistitiedon palautumisen mieleemme, eli engrammin koodaaman muiston muistamisen. Jotta jokin hermorakenne voitaisiin määritellä engrammiksi, on kyseisen rakenteen täytettävä ainakin kolme kriteeriä.
- Ensimmäinen kriteeri on, että engrammin täytyy koostua sellaisista hermosoluista, jotka olivat aktiivisia oppimistapahtuman aikana, ja jotka ovat aktiivisia muiston muistamisen aikana. Tällöin eilisen aamupalan muistoa koodaavan engrammin on koostuttava sellaisista soluista, jotka olivat aktiivisia itse aamupalan aikana, ja jotka aktivoituvat, kun yrität palauttaa eilisen aamiaisen mieleesi.
- Toinen kriteeri on se, että engrammin muodostavien hermosolujen kohdennetun aktivaation pitäisi palauttaa engrammin koodaama muisto mieleen. Toisin sanoen, jos jollakin keinolla pystyisi valikoidusti aktivoimaan eilisen aamupalan muistoa koodaavan engrammin hermosolut, pitäisi kyseisten hermosolujen aktivaation aikaansaada kyseisen muiston muistaminen.
- Kolmas kriteeri on edellisen kriteerin vastakohta. Tämän kriteerin mukaan engrammin muodostavien hermosolujen tappaminen, tai niiden toiminnan estämisen pitäisi johtaa siihen, ettei niiden koodaamaa muistoa kyetä palauttamaan mieleen. Tämä tarkoittaa, että mikäli eilistä aamupalaa koodaavan engrammin toiminta estettäisiin, pitäisi sen johtaa kyvyttömyyteen palauttaa kyseinen muisto mieleen. Muisto pitäisi siis unohtua engrammin toiminnan estämisen ajaksi.
Kaiken kaikkiaan engrammit ovat siis hermosoluista koostuvia yksiköitä, joiden ajatellaan tallentavan yksittäisten muistojen tietoja. Aktivoituessaan engrammit aktivoivat samoja hermosoluja, jotka olivat aktiivisia myös kyseisen muiston luomisen aikana. Engrammien voidaan siis ajatella mahdollistavan menneisyyden kokemusten osittaisen uudelleentoiston, jota me arkikielessä kutsumme muistojen muistamiseksi.
Miten engrammit muodostuvat oppimisen aikana?
Engrammin muodostumiseen liittyvää tapahtumaketjua ei vielä nykyään täysin ymmärretä. Tänä päivänä kuitenkin ajatellaan, että engrammin muodostuminen koostuu kolmesta eri vaiheesta.
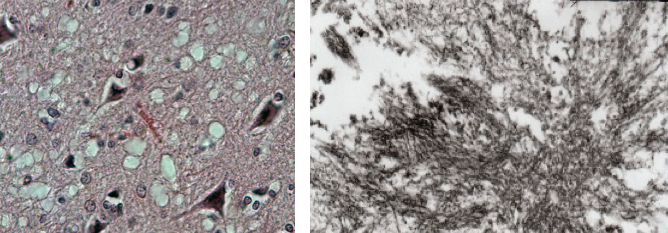
Engrammien muodostuminen alkaa allokaatiovaiheella, jossa hermosolut kilpailevat keskenään engrammiin pääsystä. Engrammiin päätyvät hermosolut valikoituvat niiden aktiivisuuden perusteella. Mitä aktiivisempi hermosolu on, sitä suurempi todennäköisyys sillä on päätyä osaksi engrammia. Allokaatiovaihetta, voi kuvitella eräänlaisena tapahtumana, jossa monta eri ihmistä (eli hermosolua) alkavat samanaikaisesti puhumaan suuressa ihmisjoukossa. Tällöin ihmiset eivät yleensä kaikki ala huutamaan toistensa päälle jatkuvasti kasvavalla äänenvoimakkuudella, vaan mitä todennäköisemmin, se ihminen, joka aloitti puhumaan kaikista korkeimmalla äänenvoimakkuudella, päätyy jatkamaan. Engrammien muodostumisen allokaatiovaihetta voidaan ajatella samankaltaisena tilanteena. Siinä korkeimman aktiivisuuden omaavat hermosolut, eli ’’äänekkäimmät’’ hermosolut, hiljentävät niiden naapureitaan enemmän kuin niiden naapurit hiljentävät niitä, jolloin äänekkäimmät, eli aktiivisimmat, yksilöt valikoituvat.
Kun engrammiin päätyvät hermosolut ovat valikoituneet, alkaa niin sanottu koodausvaihe. Koodausvaiheessa muiston tiedot kirjataan aivoihin luomalla uusia yhteyksiä engrammin hermosolujen välille. Yhteyksiä voidaan luoda esimerkiksi luomalla täysin uusia synapseja tai aktivoimalla niin sanottuja hiljaisia synapseja. Uusien synapsien luominen muokkaa aivoissa sijaitsevien hermoverkkojen rakenteita, jolloin samat ärsykkeet johtavatkin tulevaisuudessa erilaisiin vasteisiin. Esimerkiksi ennen kuin opit ajamaan autoa, punaisen liikennevalon näkeminen tuskin laukaisi sinussa vaistomaista jarrupolkimen painamista. Harjoittelun myötä aivojesi rakenne kuitenkin muuttui niin, että pelkkä punaisen liikennevalon näkeminen riittää käynnistämään automaattisen reaktion jarrupolkimen painamiseen. Tällöin sama ärsyke johtaa oppimisen myötä erilaiseen vasteeseen.
Kun muiston raaka tieto on kirjattu aivoihin muodostamalla uusia yhteyksiä, alkaa konsolidointivaihe. Konsolidointivaiheen aikana hermosolujen välisten yhteyksien vahvuuksia muokataan. Synapsien vahvuuksia voidaan muokata muuttamalla esimerkiksi synapsien kokoa tai niiden sijaintia hermosolulla. Konsolidointivaihe on erittäin tärkeä muistojen löydettävyyden kannalta. Muistojen löydettävyydellä tarkoitetaan ympäristön kykyä palauttaa jokin muisto meidän mieleemme. Jos muiston löydettävyys on korkea, kuten jos joku on kokenut traumaattisen tapahtuman, riittää mahdollisesti jokin hyvin lievästi traumaattista tilannetta muistuttava ympäristö laukaisemaan muiston traumaattisesta tapahtumasta. Jos taas muiston löydettävyys on alhainen, täytyy ympäristön muistuttaa alkuperäistä ympäristöä hyvin paljon, jotta muisto alkuperäisestä ympäristöstä palautuisi mieleen.
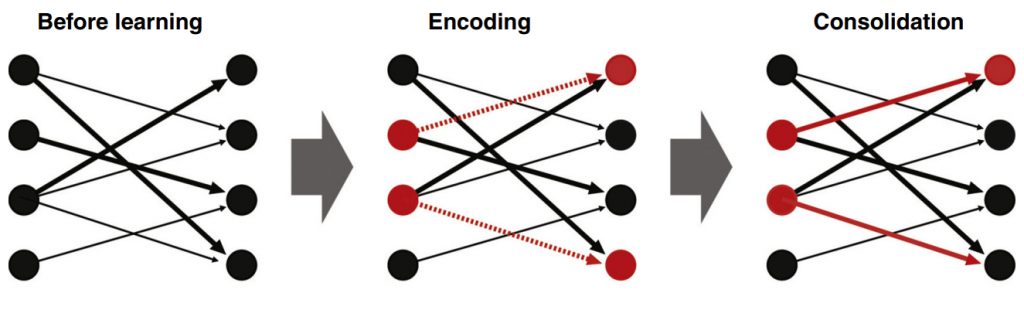
Kuva 2. Engrammin muodostuminen alkaa allokaatiovaiheella, jossa aktiivisimmat hermosolut (punaiset hermosolut) valikoituvat suuren hermosolujoukon seasta. Tämän jälkeen alkaa koodausvaihe (Encoding), jossa engrammin informaatio kirjataan uusiin yhteyksiin engrammin muodostavien hermosolujen välille. Konsolidointivaiheessa (Consolidation), aiemmin luotuja yhteyksiä vahvistetaan muistojen löydettävyyden parantamiseksi. (Kuva: Tonegawa Susumu ym. (2015). Curr Opin Neurobiol, 35, 101-109.)
Eräs esimerkki, joka havainnollistaa hyvin eron engrammien tiedon ja kyseisen tiedon löydettävyyden välillä on eri kielillä puhuminen. Jos hallitset esimerkiksi englannin kielen hyvin, mutta et ole käyttänyt sitä pitkään aikaan, saattaa englanninkielentaitosi ruostua. Kun yrität käyttää englantia, saatat aluksi unohtaa sanoja, käyttää hieman vääriä lauseenrakenteita tai päätyä vahingossa käyttämään täysin eri kielten sanastoa. Jos kuitenkin pääset lämmittelemään englannin kielellä puhumista jatkamalla sen käyttöä esimerkiksi viikon ajan, huomaat, että edellä mainitut virheet vähenevät ja kielen käytöstä tulee taas hyvin intuitiivista.
Kyseinen tilanne havainnollistaa engrammien sisältämän tiedon ja sen löydettävyyden erot. Riippumatta siitä, käytätkö arkielämässäsi englannin kieltä tai et, aiemmin opitut englannin kielen taidot tallentuvat aivojesi rakenteeseen. Jos et kuitenkaan käytä kieltä aktiivisesti, kyseisen tiedon löydettävyys heikkenee, jolloin kyseistä tietoa on vaikeampi palauttaa mieleen. Tällöin kielenkäyttö on hieman tönkköä ja kieltä käytettäessä tulee helposti tehtyä virheitä. Kuitenkin kielen käytön yhteydessä kyseistä tietoa koodaavien engrammien löydettävyys paranee, jolloin tarvittavat englannin kielen sanat alkavat taas ilmestymään täysin automaattisesti mieleen, eikä niitä tarvitse alkaa muistelemaan kesken keskustelun.
Mielenkiintoisia tuloksia ja mahdollisia tulevaisuuden käyttötarkoituksia
Niin kuin aiemmin mainittiin, muistojen tieto ja yksilöiden kyky palauttaa kyseinen tieto mieleen, eli muistojen löydettävyys, ovat erillisiä asioita. Hiirillä tehdyissä tutkimuksissa on huomattu, että muistojen luomisen aikana on mahdollista estää muistojen löydettävyyden kannalta tärkeä konsolidointivaihe, ilman koodausvaiheen häiritsemistä. Jos konsolidointivaihe estetään, hiirille muodostuu retrogradinen muistinmenetys, jossa tieto kirjataan hiirien aivoihin käyttökelvottomassa muodossa. Tämä tieto on kuitenkin mahdollista muuttaa käyttökelpoiseksi, jos kyseistä tietoa tallentavan engrammin yhteyksiä vahvistetaan aktivoimalla engrammia keinotekoisesti.
Kyseisistä tutkimuksista saatua tietoa on mahdollista hyödyntää tulevaisuudessa tietyntyyppisten muistinmenetysten hoidossa. Jos muistojen tietoa tallentavien engrammien solut ovat vielä elossa, mutta engrammien heikko löydettävyys tekee engrammeista käyttökelvottomia, ei olisi täysin poissuljettua, että kyseisten engrammien löydettävyyttä voitaisiin kasvattaa, jolloin muistot muuttuisivat taas potilaille käyttökelpoisiksi.
Yksittäisten engrammien kohdennetulla keinotekoisella aktivoimisella tai sammuttamisella on myös potentiaalisia terapeuttisia käyttötarkoituksia. Hiiritutkimuksissa on onnistuttu sammuttamaan hiirien pelottavia muistoja koodaavia engrammeja, jolloin hiirten tietyissä tilanteissa kokema pelko saatiin katoamaan. Eräässä tutkimuksessa on taas onnistuttu hoitamaan hiirien stressiperäistä masennusta aktivoimalla masentuneissa hiirissä positiivisia muistoja koodaavia engrammeja.
Ei siis ole täysin poissuljettua, että engrammien tutkimuksista saatua tietoa voitaisiin tulevaisuudessa soveltaa monenlaisiin ongelmiin. On mahdollista, että positiivisia muistoja koodaavien engrammien aktivaatio voisi toimia myös ihmisissäkin ainakin tiettyjen masennustyyppien hoidoissa. Muita ongelmia, joissa engrammitutkimuksia voitaisiin soveltaa, on addiktioiden ja traumaperäisten stressihäiriöiden hoito. Jos alkoholiriippuvuudesta kärsivien potilaiden alkoholiin liittyvien muistojen engrammeja voitaisiin manipuloida ja näiden muistojen alkoholiin liittyvää mielihyväkomponenttia heikentää, on mahdollista, että potilaiden vetovoimaa alkoholiin voitaisiin vähentää. Traumaperäisen stressihäiriöiden tapauksessa taas voitaisiin heikentää muistojen emotionaalista komponenttia, jolloin ihmisten traumaattiset kokemukset eivät vaikuttaisi potilaiden elämään yhtä voimakkaasti. Tällöin engrammien manipulaatiolla olisi mahdollisuus tulevaisuudessa parantaa potilaiden elämänlaatua huomattavasti.
Engrammien tutkimuksesta saadulla tiedolla ja engrammien manipulaatiolla on siis monia mahdollisia käyttötarkoituksia tulevaisuudessa. On kuitenkin pidettävä mielessä, että kaikista engrammien manipulaation potentiaalisista tulevaisuuden käyttötarkoituksista huolimatta, engrammien manipulaatio ei tällaisenaan ole vielä valmista terapeuttista käyttöä varten. Suurin este engrammien manipulaatioon ihmisissä on menetelmien suuri invasiivisuus, toiselta nimeltään kajoavuus. Jotta jotakin engrammia kyettäisiin manipuloida, täytyy engrammi ensin leimata, mikä vaatii monien eri geenien siirtoa kohde-eläimen hermosoluihin. Hiirien tapauksessa tämä onnistuu tutkimuskäytössä, mutta ihmisillä tätä ei turvallisuussyistä vielä voida tehdä. Tämän lisäksi engrammien tutkimus on vielä varhaisvaiheessa, mikä tarkoittaa, että alalla on tehtävä vielä paljon tutkimusta, jotta tästä tiedosta voitaisiin muodostaa toimivia ja turvallisia hoitomenetelmiä. Alan varhaisesta vaiheesta huolimatta, engrammien tutkimus on kuitenkin lisännyt meidän ymmärrystämme muistin toiminnasta, sekä luonut pohjan monelle potentiaaliselle tulevaisuuden hoitomenetelmälle.
Luettavaa aiheesta kiinnostuneille:
- Josselyn, S. A. and S. Tonegawa (2020). ”Memory engrams: Recalling the past and imagining the future.” Science367(6473).
- Poo, M. M., et al. (2016). ”What is memory? The present state of the engram.” BMC Biol 14: 40.
- Ryan, T. J., et al. (2021). ”Engram cell connectivity: an evolving substrate for information storage.” Curr Opin Neurobiol 67: 215-225.
- Straube, B. (2012). ”An overview of the neuro-cognitive processes involved in the encoding, consolidation, and retrieval of true and false memories.” Behavioral and Brain Functions 8, 35.
Tietoa kirjoittajasta:

Alexei Kramm on neurotieteen maisteriopiskelija Helsingin yliopistossa. Alexei on kiinnostunut muistin ja oppimisen mekanismeista ja hän kirjoitti kandityönsä engrammeista. Sähköposti: alexei.kramm@helsinki.fi