Mikä on tämän vuosikymmenen suurin tieteellinen läpimurto? Tuskin osuu kovin väärään veikatessaan, että titteli menee kansankielellä geenisaksiksi kutsutulle CRISPR-Cas9-menetelmälle. Menetelmä on mullistanut perustutkimuksen lisäksi bioteknologian kasvinjalostuksesta lääkekehitykseen, ja uusia sovelluksia kehitetään jatkuvasti. Mikä sitten tekee menetelmästä niin erityisen, ja miten sitä voidaan hyödyntää hermoston ja sen sairauksien tutkimuksessa?
Ihmisen genomikartan valmistuminen vuonna 2003 ja sitä seurannut uuden sukupolven
sekvensointimenetelmien kehitys ovat merkittävästi lisänneet tietoa hermoston sairauksien taustalla vaikuttavista perinnöllisistä tekijöistä. Esimerkiksi autismille tai skitsofrenialle altistavia geenimuunnoksia on löydetty satoja. Yksi geenivariantti ei sairautta kuitenkaan aiheuta kuin harvinaisissa tapauksissa. Tämän hetken suurimpia haasteita onkin ymmärtää, miten nämä alttiusgeenit yhdessä ulkoisten tekijöiden kanssa vaikuttavat tautiriskiin ja taudin patofysiologiaan. Tarvitaan perusteellista tietoa siitä, miten ja missä ympäristössä geenit toimivat ja miten ne vaikuttavat ilmiasuun. Juuri tässä niin kutsutussa toiminnallisessa genomitutkimuksessa CRISPR-Cas9 on osoittautunut verrattomaksi apuvälineeksi.
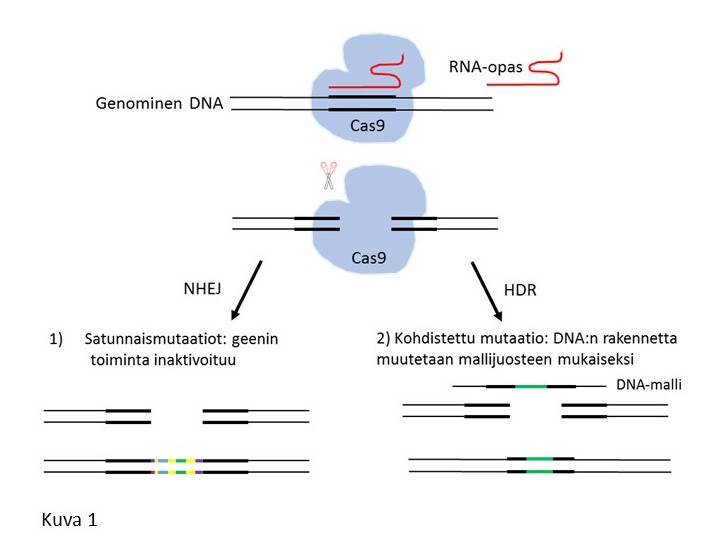
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats)-Cas9 (CRISPR-associated protein 9)-menetelmä perustuu bakteerien immuunijärjestelmän luontaiseen kykyyn puolustautua viruksia vastaan (1). Keskeinen osa menetelmää on lyhyt RNA-opas (guide RNA), joka ohjaa Cas9-proteiinin sitoutumaan DNA-juosteeseen tarkasti tietyssä kohdassa genomia (kuva 1). DNA:han sitoutunut Cas9 katkaisee juosteen RNA-oppaan määräämässä paikassa, minkä jälkeen solun omat korjausmekanismit korjaavat juosteen. Tässä vaiheessa genomista voidaan poistaa tai siihen voidaan liittää uusia DNA-pätkiä. CRISPR-Cas9 toimii siis ikään kuin genomin ”hae ja korvaa”-toimintona. Tämän alkuperäisen geenisaksi-toiminnon lisäksi Cas9-proteiinista on kehitetty useita muokattuja versioita. Niiden avulla voidaan esimerkiksi säädellä geenin ilmentymistä tai leimata haluttu geeni fluoresoivalla merkkiproteiinilla (2). Geenien toiminnan tutkiminen aivoissa on erityisen haasteellista johtuen hermosolujen pitkälle erilaistuneesta luonteesta. Hermosolun ja sen geenien toiminta voi olla hyvinkin erilaista esimerkiksi aivojen eri osissa, riippuen solun mikroympäristöstä ja yhteyksistä muihin soluihin. Soluviljelmät ja eläinmallit ovat merkittävässä roolissa hermostosairauksien mekanismeja selvitettäessä ja uusien lääkkeiden kehityksessä. CRISPR-Cas9-tekniikan avulla voidaan muokata hermosolujen perimää eläinmallissa paikallisesti halutussa kohdassa aivoja ja jopa tietyssä solutyypissä (kuva 2) (3). Tätä voidaan hyödyntää esimerkiksi iän myötä kehittyvien hermorappeumatautien tutkimuksessa tai selvitettäessä tietyn geenin vaikutusta ahdistuneisuushäiriöiden syntyyn.
Kuva 1. CRISPR-Cas9-menetelmän periaate. RNA-opas (guide RNA), joka voidaan syntetisoida laboratoriossa, ohjaa emäspariutumisen avulla Cas9-entsyymin haluttuun kohtaan genomia. Cas9 katkaisee DNA-juosteen tarkasti tästä kohtaa. Solu korjaa DNA-säikeen käyttämällä joko NHEJ-reittiä (1), jossa katkenneen DNA:n päät liitetään yhteen ilman mallijuostetta. Tällöin DNA:n leikkauskohtaan jää tyypillisesti satunnaisia mutaatiota ja geenituotteesta tulee viallinen (poistogeeniset mallit). Vaihtoehtoisesti voidaan hyödyntää solun HDR-reittiä (2), jossa solu korjaa katkaistun juosteen mallijuosteen avulla. Mallijuosteen avulla voidaan genomiin liittää haluttu uusi DNA-jakso. NHEJ=non-homologous end-joining, HDR=homology directed repair.
Valtaosa neurologisista ja psykiatrisista sairauksista on taustaltaan hyvin monimuotoisia, usean, jopa satojen geenivarianttien ja ympäristön yhteisvaikutuksen tuloksena syntyneitä. Esimerkiksi yleisintä muistihäiriöitä aiheuttavaa sairautta, Alzheimerin tautia, sairastavista vain alle yksi prosentti sairastaa taudin periytyvää muotoa (4). CRISPR-Cas9 mahdollistaa useiden mutaatioiden luomisen solu- tai eläinmallissa samanaikaisesti, mikä on tärkeää selvitettäessä geenien välisiä vuorovaikutuksia ja monitekijäisten tautien syntymekanismeja. CRISPR-Cas9:n avulla voidaan seuloa samanaikaisesti jopa kymmenien geenien vaikutusta ilmiasuun yksinkertaisissa mallieliöissä (esim. seeprakala) tai kantasoluissa. Siirtogeenisen hiirimallin luominen, joka ennen vei kaksikin vuotta, onnistuu nyt CRISPR-Cas9-tekniikalla edullisemmin ja alle puolessa vuodessa (kuva 2) (5).
Ehkä merkittävin CRISPR-Cas9-menetelmän etu on kuitenkin tekniikan hyödynnettävyys yli lajirajojen. CRISPR-Cas9 on toistaiseksi toiminut kaikissa testatuissa eliöissä sukkulamadoista apinoihin. Vaikka hiirimallit ovat erottamaton osa biolääketieteellistä tutkimusta, erityisesti korkeamman tason aivotoimintoja tutkittaessa niiden käyttömahdollisuudet ovat usein rajallisia. CRISPR-Cas9-tekniikan avulla voidaan kehittää uusia eläinmalleja esimerkiksi kädellisillä tai sosiaalisilla lintulajeilla. Lähemmin ihmisten tautia muistuttavat eläinmallit ovat olennaisia myös lääkekehitykselle, koska yli 80 prosenttia hiirimalleissa toimiviksi ja turvallisiksi testatuista lääkkeistä osoittautuu tehottomiksi ihmiskäytössä (6).
Entä ihminen? Voidaanko CRISPR-Cas9-menetelmää tulevaisuudessa käyttää sairauksien hoidossa tai jopa parantamaan pysyvästi perinnöllisiä hermosairauksia? CRISPR-Cas9-menetelmää kokeiltiin ihmisen geeniterapiassa ensi kertaa viime kesänä. Kiinalaiset tutkijat siirsivät keuhkosyöpäpotilaalle menetelmällä muokattuja immuunipuolustukseen osallistuvia T-soluja, tavoitteena tuhota kasvainkudos (7). Menetelmää on testattu myös ihmisalkioiden perimän muokkaamiseen (Suomessa ihmisen sukusolulinjan muokkaaminen ei ole sallittua). Vaikka näitä geenimuunneltuja alkioita ei ollut koskaan tarkoitus kasvattaa ihmiseksi asti, kokeilut aiheuttivat suurta kohua sekä tutkijapiireissä että mediassa. Tieto CRISPR-Cas9:n sivuvaikutuksista on kuitenkin toistaiseksi riittämätöntä, jotta menetelmää voitaisiin käyttää laajamittaisesti sairauksien hoidossa. Emme tiedä tarkasti, kuinka usein CRISPR-Cas9 katkaisee DNA:ta väärästä kohdasta. Emme myöskään tiedä, millaisen puolustusreaktion vieraan proteiinin, Cas9:n, vieminen ihmiselimistöön saa aikaan. Tietomme sairauksien perusmekanismeista on liian vähäistä voidaksemme arvioida, mitä yhden geenin muokkaaminen saa kudoksessa aikaan pitkällä tähtäimellä.
Vielä on turhan varhaista sanoa, pystytäänkö CRISPR-Cas9-tekniikkaa tulevaisuudessa hyödyntämään hermoston sairauksien hoidossa. Periaatteessa menetelmää voitaisiin käyttää yhden geenin aiheuttamien sairauksien geenivirheiden korjaamiseen. Esimerkiksi ihmisellä vakavan keskushermoston rappeumasairauden, Huntingtonin taudin, aiheuttava mutaatio Huntingtin-geenissä on onnistuneesti korjattu CRISPR-Cas9-menetelmällä viljellyissä soluissa (8). Silmän verkkokalvon rappeumatautiin (retinitis pigmentosa) johtavan geenivirheen korjaaminen CRISPR-Cas9-tekniikalla rottamallissa puolestaan palautti osittain rottien näkökyvyn (9). Ennen tällaisten geenihoitojen mahdollistumista ihmisellä on kuitenkin ratkaistava monta suurta CRISPR-Cas9-tekniikkaan ja toisaalta hermosairauksien ominaispiirteisiin liittyvää ongelmaa. Suuri haaste on, miten geeniterapia saadaan kohdistettua oikeaan kudokseen ja solutyyppiin oikeaan aikaan. Monet hermoston sairaudet, kuten skitsofrenia ja perinnöllinen kehitysvammaisuutta aiheuttava fragiili X-oireyhtymä, ovat kehityksellisiä luonteeltaan. Tämä tarkoittaa, että hermosoluissa tapahtuu patofysiologisia muutoksia jo kehityksen aikana, ennen oireiden alkua. Tällöin geenivirheen korjaaminen sairauden puhjettua ei enää pysty parantamaan tautia. Toistaiseksi viallisen geenin korvaaminen CRISPR-Cas9-tekniikalla on myös ollut varsin tehotonta jopa jakautuvissa soluissa kuten maksan hepatosyyteissä (10), puhumattakaan jakautumattomista hermosoluista. Lisäksi on muistettava, että monitekijäisiä hermostosairauksia, joiden taustalla ovat geenien ja ympäristön monimutkaiset vuorovaikutussuhteet, ei voida hoitaa yhden geenin toimintaa korjaamalla.
CRISPR-Cas9-menetelmän kehitys on edennyt viime vuodet aallonharjalla ja tehnyt myös ihmisen perimän muokkaamisen mahdolliseksi tavalla, jota emme aiemmin osanneet kuvitellakaan. Menetelmästä on tullut pysyvä osa molekyylibiologian työkalupakkia ja se on nopeuttanut merkittävästi myös hermoston ja sen sairauksien tutkimusta. Nyt on korkea aika käydä laajaa yhteiskunnallista ja eettistä pohdintaa geenimuokkauksen käytön rajoista ja siitä, mihin tulevaisuudessa olemme menetelmää valmiita käyttämään.
Kuva 2. CRISPR-Cas9-menetelmän hyödyntäminen neurologisten tautien tutkimuksessa. Kun geneettisissä tutkimuksissa on löydetty yhteys tiettyjen geenien ja esimerkiksi Alzheimerin taudin välille, voidaan CRISPR-Cas9 tekniikkaa käyttää muokkaamaan alttiusgeenejä mallieliöissä. CRISPR-Cas9-tekniikan avulla pystytään nopeasti ja edullisesti luomaan tautimalleja esimerkiksi hiirellä (1). Eläinmalleissa voidaan tutkia erilaisten ympäristötekijöiden (esim. stressi, ruokavalio) ja geenien yhteisvaikutusta taudin syntyyn. CRISPR-Cas9 tekniikkaa voidaan käyttää myös geenin toiminnan tutkimiseen paikallisesti tietyllä aivoalueella, kuten muistin toiminnalle tärkeässä hippokampuksessa (2). CRISPR-Cas9 menetelmää hyödynnetään paljon myös viljellyissä soluissa (esim. hermosoluviljelmät), joissa geenin solutason vaikutusten tutkiminen on helpompaa (3). Jotta alttiusgeenien vaikutukset taudin syntyyn ja patofysiologiaan ymmärretään riittävän hyvin, tarvitaan yleensä perusteellisia tutkimuksia eri tasoilla (1-3). Tämä mahdollistaa taudin varhaisemman diagnosoinnin ja täsmähoitojen kehittämisen. Tulevaisuudessa joitakin tauteja voidaan mahdollisesti hoitaa CRISPR-Cas9-menetelmän avulla.
Aino Vesikansa toimii tutkijatohtorina Helsingin yliopiston HiLife-yksikössä Viikin kampuksella ja kehittää omassa työssään CRISPR-Cas9-menetelmiä ahdistuneisuushäiriöiden molekyylimekanismien tutkimukseen. Sähköposti: aino.vesikansa@helsinki.fi.
Viitteet:
- Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17;337(6096):816-21.
- Hsu PD, Lander ES, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 2014 Jun 5;157(6):1262-78.
- Heidenreich M, Zhang F. Applications of CRISPR-Cas systems in neuroscience. Nat Rev Neurosci. 2016 Jan;17(1):36-44.
- Van Cauwenberghe C, Van Broeckhoven C, Sleegers K. The genetic landscape of Alzheimer disease: clinical implications and perspectives. Genet Med. 2016 May;18(5):421-30.
- Cohen J. Mice made easy. Science. 2016 Nov 4;354(6312):538-42.
- Perrin S. Preclinical research: Make mouse studies work. Nature. 2014 Mar 27;507(7493):423-5.
- Cyranoski D. CRISPR gene-editing tested in a person for the first time. Nature. 2016 Nov 24;539(7630):479.
- Shin JW, Kim KH, Chao MJ, Atwal RS, Gillis T, MacDonald ME, et al. Permanent inactivation of Huntington’s disease mutation by personalized allele-specific CRISPR/Cas9. Hum Mol Genet. 2016 Sep 15.
- Suzuki K, Tsunekawa Y, Hernandez-Benitez R, Wu J, Zhu J, Kim EJ, et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. 2016 Dec 1;540(7631):144-9.
- Yin H, Xue W, Chen S, Bogorad RL, Benedetti E, Grompe M, et al. Genome editing with Cas9 in adult mice corrects a disease mutation and phenotype. Nat Biotechnol. 2014 Jun;32(6):551-3.