Autismikirjon häiriö on aivojen neurobiologinen häiriö, jolla on skitsofrenian tapaan todettu vahva geneettinen tausta (de la Torre-Ubieta ym., 2016). Autismikirjolle on tunnusomaista vaikeudet sosiaalisessa vuorovaikutuksessa ja kommunikaatiossa sekä pakonomaiset rutiinit ja rajoittuneet kiinnostuksen kohteet. Käsite ´kirjo´ viittaa oireistoon, joka sisältää erilaisia kliinisiä variaatioita, kuten lapsuusiän autismi (Kannerin oireyhtymä, klassinen autismi), Aspergerin oireyhtymä, Rettin oireyhtymä, epätyypillinen autismi sekä tarkemmin määrittelemätön lapsuuden laaja-alainen kehityksen häiriö. Autismikirjon variaatiot on viimeisimmässä American Psychiatric Associationin 2013 julkaisemassa mielenterveyden ja käyttäytymisen häiriöiden diagnoosijärjestelmässä (DSM-5) luokiteltu yhdeksi autismikirjon häiriöksi (Autism Spectrum Disorder). Suomen terveydenhuollossa käytetään Maailman terveysjärjestön (WHO) julkaisemaa ICD-luokitusta, jonka seuraavassa, valmisteilla olevassa (ICD-11) versiossa seurattaneen DSM-5:n luokitustapaa autismin osalta. Autismia esiintyy koko maailmassa ja sen esiintyvyyden on todettu viimeisen kymmenen vuoden aikana lisääntyneen pääosin parantuneen diagnostiikan vuoksi. Viimeisimpien suomalaisten epidemiologisten tutkimusten mukaan autismikirjon yleisyydeksi on arvioitu noin 1%, jolloin Suomessa on n. 50–80 000 henkilöä, joilla on autismikirjon diagnoosi.
Yksilön kehitysympäristöllä ja kokemuksilla on merkittävä vaikutus sosiaalisten taitojen kehittymiseen ja käyttäytymiseen, mutta vallitseva tieteellinen käsitys on, että geneettiset muutokset ovat useimmissa tapauksissa autismikirjon henkilöiden käyttäytymisen erityispiirteiden syy. Kansainvälinen geenitutkimus on tunnistanut ison joukon geenejä, joiden muutokset on yhdistetty autismiin. Tämä tarkoittaa sitä, että aivojen normaalille toiminnalle tärkeiden geenien (yhden tai useamman) määrittämien proteiinien toiminta tai tuotantotaso on muuttunut autismikirjon henkilöillä normaalipopulaatioon verrattuna (de la Torre-Ubieta ym., 2016). Hiirikokeilla on voitu osoittaa, että ihmisillä havaitut autismikirjoon linkitetyt geenimuutokset ovat riittäviä aiheuttamaan autismiin liittyvien erityispiirteiden kaltaista käyttäytymistä myös hiirillä. Testattaessa autismikirjon häiriöön liittyviä käyttäytymisen erityispiirteitä hiirillä, täytyy käytettävät testit soveltaa sopimaan hiirten elämään. Hiiret, kuten ihmisetkin, ovat kuitenkin sosiaalisia eläimiä ja sosiaalisuutta voi hiirillä testata eri tavoin. Yhdessä yksinkertaisimmista testeistä seurataan, onko hiiri kiinnostuneempi toisesta hiirestä kuin esineestä. Normaalihiiret ovat kiinnostuneempia toisesta hiirestä, kun taas autistisesti käyttäytyvät hiiret eivät tee eroa hiiren ja esineen välillä. Toisessa helpossa testissä seurataan hiiren yleiskäyttäytymistä, missä autistinen käyttäytyminen voi ilmetä hiirelle tyypillisen käyttäytymisen pakonomaisena toistona, esimerkiksi poskien sukimisessa tai takajaloille nousemisessa. Autististen hiirenpoikasten emon kanssa äänteleminen eroaa myös normaalisti kehittyvien hiirenpoikasten ääntelystä. Hiirien kognitiivisia taitoja voidaan testata erilaisilla oppimis- ja muistamiskokeilla. Hiirien tasapainoa ja koordinaatiota arvioidaan mittaamalla hiirten kykyä juosta eri paksuisten keppien tai pyörivän rullan päällä. Eri geenimuutokset aiheuttavat omanlaisen vasteensa; muutos tietyssä geenissä saattaa aiheuttaa vain yhden autismille tyypillisen erityispiirteen, kun taas toinen geneettinen muutos saattaa aiheuttaa toisenlaisia muutoksia käyttäytymisessä. Yleisesti voidaan nähdä, että mitä useampaan geeniin geneettinen muutos vaikuttaa, sitä selvempi on myös muutos käyttäytymisessä. Tällä hetkellä geneetikot ja neurobiologit yrittävät ymmärtää, mitä yhteistä autismin riskigeeneillä on ja millaisia muutoksia hermosoluissa ja aivoissa tarvitaan autismikirjon perusoireiden ilmenemiseen käyttäytymisen tasolla. Jos oireille löydetään yhteinen nimittäjä, voidaan mahdollista hoitoa kohdentaa paremmin. Koska autismin neurobiologinen syy on vielä tuntematon, joudumme testeissä edelleen sekä hiirillä että ihmisillä luottamaan käyttäytymisessä tai aistien toiminnassa havaittaviin muutoksiin. Esimerkiksi motoriikan ja koordinaation suhteen on tehty uraauurtavaa tutkimusta autismikirjon häiriöissä. Ja vaikka autismia aiheuttavat perussyyt ovat edelleen hämärät, niin myös verestä tai virtsasta tehtävien analyysien perusteella ollaan kehittelemässä uusia välineitä häiriöiden tarkempaa diagnosointia varten.
Vain osa autismiin liittyvistä geenien muutoksista periytyy vanhemmilta ja usein geenimuutokset ovat uusia, vanhempien sukusoluissa tai alkion kehityksen aikana tapahtuvia muutoksia (de la Torre-Ubieta ym., 2016). Geneettisiä tutkimuksia on hankaloittanut autismikirjoon yhdistettyjen geenien valtava määrä; tällä hetkellä mahdollisia autismikirjon häiriön piirteitä aiheuttavia geenejä on yhteensä noin tuhat. Näin ollen lähes jokaisella autismikirjon henkilöllä on ”oma” geenivariaationsa ja kausaliteettia geenimutaation ja käyttäytymisen häiriöiden välille on vaikea osoittaa pitävästi. On hyvä muistaa, että jokainen neurotyypillinen ihminen kantaa satoja mutaatioita tai geenivariaatioita genomissaan, ja suurin osa mutaatioista tai variaatioista ei haittaa normaalia elämää millään lailla. Geenivariaatioiden suuri määrä myös auttaa ymmärtämään sitä, miksi jokainen autismikirjon henkilö on omanlaisensa. Vaikka peruspiirteet ilmenevät samankaltaisina eri henkilöillä, on jokaisen autismikirjon henkilön ilmiasun piirteet hieman erilaiset sekä laadullisesti että määrällisesti
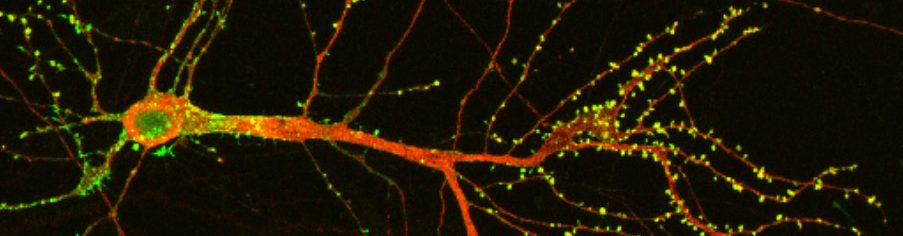
Monet autismikirjoon yhdistetyistä geeneistä koodaavat proteiineja, jotka ovat tärkeitä synapsien toiminnassa (Bourgeron, 2015). Synapsit ovat hermosolujen liitoskohtia ja koko hermoverkon toimimisen perusta, joten löydös ei yllätä. Hermosolut muodostavat hermoverkon, missä hermosololuja yhdistää sekä kiihdyttäviä että estäviä synapseja. Hermosolun aktivaatio riippuu siitä kuinka moni kiihdyttävä synapsi ja miten usea estävä synapsi aktivoituu; hermosolu ikään kuin summaa plus ja miinus viestit ja päättää siitä, laittaako se signaalin eteenpäin. Osa autismiin liitettyjen geenien koodaamista proteiineista järjestelee synapsien komponentit oikeaan järjestykseen. Osa autismigeenien tuottamista proteiineista osallistuu synapsien toiminnalle keskeiseen ionien kuljetukseen solun sisään ja solusta ulos. Osa proteiineista taas säätelee synapsin ”kotia” eli hermosolujen viejähaarakkeen, dendriitin, okasta. Nämä löydökset sopivat hyvin yhteen sen kanssa, että autismikirjon häiriöstä kärsivien lasten aivojen hermsoluissa on havaittu poikkeavan paljon dendriittien okasia (ja todennäköisesti myös synapseja) (Tang ym., 2014). Okasten ja kiihdyttävien synapsien riittämätön poistaminen kehityksen aikana sopisikin hyvin olemaan yksi neurobiologinen syy autismikirjon häiriöön (Tang ym., 2014). Ihmisen normaalikehityksen aikana okasia tuotetaan lapsuudessa ensin ylen määrin ja myöhemmin ylimääräiset okaset poistetaan: synapsien määrän ”optimoinnin” oletetaan sujuvoittavan aivojen käyttöä. Osa tuloksista viittaa myös siihen että synapseja ei ehkä vahvisteta normaalisti, vaan ne jäävät pieniksi ja heikoiksi. Myös okaset, joissa synapsit majailevat, jäävät liian pitkiksi ja ohuiksi. Tällöin voidaan ajatella, että synapseja muodostuu liiankin tehokkaasti, mutta valinta muodostettavien ja poistettavien välillä jää vajaaksi, eli ”mitä tahansa” tietoa tallennetaan aivoihin ilman kunnollista valintaa tiedon tallennuksen mielekkyydestä. Silloin kaikesta aivojen vastaanottamasta ja käsittelemästä tiedosta tulee samanarvoista eikä esimerkiksi sosiaalista kanssakäymistä erityisesti ”tueta” keskushermoston osalta. Vahvistusmekanismien puuttuminen myös vähentää aivojen tiedonkäsittelyn tehoa. On myös tutkimusnäyttöä siitä, että synapsit saattaisivat kehittyä ”valmiiksi” liian aikaisin ja siksi kehityksen aikaiset muutokset aivoissa jäävät vajaiksi (Sun ym., 2018).
Synapsien toiminta ja kehitys voisivat olla yksi yhteinen nimittäjä autismikirjon taustalla, mutta se miten synapsien toiminta muuttuu ja miksi, on edelleen epäselvää.
Eläinmalleilla tehtyjen tutkimusten tulokset viittaa siihen, että autismissa kiihdyttävien ja estävien synapsien tasapaino on muuttunut. Yleensä kiihdyttävät synapsit vievät signaalia eteenpäin, kun taas estävät synapsit pitävät signaalin etenemisen ”kurissa”. Molempien synapsien toiminta ja toiminnan tasapaino sekä oikea-aikaisuus on ensiarvoisen tärkeää aivojen normaalille toiminnalle. Voidaan spekuloida, että jos estävien synapsien toiminta on heikentynyt, hermoimpulssi leviää liian laajasti aivoihin ja pienikin ulkopuolelta tuleva ärsyke saattaa ärsyttää kohtuuttomasti aivoja ja näin myös itse aivojen omistajaa. Tämä saattaa myös johtaa siihen, että aivoissa on liikaa ”kohinaa” jolloin tärkeiden ärsykkeiden havaitseminen ja vahvistaminen hankaloituu. Voi olla että liiallinen lajittelematon ärsykkeiden määrä (kohina) estää olennaiseen keskittymisen, yksilö keskittyy yksityiskohtiin kokonaisuuden asemesta eli ei näe metsää puilta. Aivojen yliärsytys saattaa myös johtaa epileptisiin kohtauksiin, mikä onkin nähtävissä osalla autismikirjon henkilöistä. Viimeaikainen hiirimalleilla tehty tutkimus on osoittanut, että jos epileptisten kohtausten aikana tapahtuvaa hermosolujen yliärsytystä hillitään lääkeaineilla, aivojen kehitys voi palata normaaliksi (Sun ym., 2018).
Autismikirjon häiriöt kattavat laajan kirjon häiriöitä, joissa tuen ja hoidon tarve on vaihteleva ja yksilöllisesti määräytyvä. Käytössä oleva lääkkeellinen hoito kohdistuu rinnakkaisoireisiin ja neuropsykiatrisiin liitännäissairauksiin. Autismikirjon henkilöiden aivojen toiminnalliset erityispiirteet ja yksilöllisyys hankaloittavat hoitoja ja siksi olisi tärkeää löytää yksi tai useampi autismikäyttäytymistä aiheuttava biologinen syy, mihin hoidot voitaisiin kohdentaa. Tähän mennessä Fragile-X-oireyhtymää mallittavalla hiirimallilla tehty tutkimus on osoittanut, että synapsien määrää tai toimintaa normalisoimalla voidaan vähentää eläinten autisminkaltaista käyttäytymistä. Tämä onnistui vielä hiirien ollessa aikuisia, mikä viittaa siihen, että ainakin osa autismikirjohäiriöistä voitaisiin parantaa vielä aikuisiässä.
Tietoa kirjoittajista:
Pirta Hotulainen toimii ryhmänjohtajana Lääketieteellinen Tutkimuslaitos Minervassa ja omassa työssään hän tutkii miten autismikirjon häiriöön liitetyt geneettiset muutokset vaikuttavat hermosolujen yhteyksiin. Sähköposti: pirta.hotulainen@helsinki.fi
Irene Rämä toimii Helsingin yliopiston Koulutuksen arviointikeskuksessa tutkijatohtorina. Hänen tutkimusintressinsä kohdistuvat pääasiassa vaativan erityisen tuen alueelle, etenkin autismikirjoon, jossa sosiaaliseen vuorovaikutukseen ja kommunikaatioon liittyvät aiheet sekä oppimiseen ja opettamiseen kiinnittyvät seikat ovat hänen tieteellisen kiinnostuksen kohteitaan.
 Maija Castrén toimii Suomen Akatemian kliinisenä tutkijana Helsingin yliopistossa ja tutkii autismikirjon häiriöiden taustalla olevia molekulaarisia mekanismeja sekä mahdollisuuksia niihin vaikuttamalla kehittää kliinisiä hoito- ja kuntoutusmuotoja. Sähköposti: maija.castren@helsinki.fi
Maija Castrén toimii Suomen Akatemian kliinisenä tutkijana Helsingin yliopistossa ja tutkii autismikirjon häiriöiden taustalla olevia molekulaarisia mekanismeja sekä mahdollisuuksia niihin vaikuttamalla kehittää kliinisiä hoito- ja kuntoutusmuotoja. Sähköposti: maija.castren@helsinki.fi
Viitteet:
- Bourgeron, T. From the genetic architecture to synaptic plasticity in autism spectrum disorder. Nat Rev Neurosci 16, 551-563, doi:10.1038/nrn3992 (2015).
- de la Torre-Ubieta, L., Won, H., Stein, J. L. & Geschwind, D. H. Advancing the understanding of autism disease mechanisms through genetics. Nat Med 22, 345-361, doi:10.1038/nm.4071 (2016).
- Tang, G. et al. Loss of mTOR-dependent macroautophagy causes autistic-like synaptic pruning deficits. Neuron 83, 1131-1143, doi:10.1016/j.neuron.2014.07.040 (2014).
- Sun, H., Takesian, A.E., Wang, T.T., Lippman-Bell, J.J., Hensch, T.K., Jensen, F.E. Early Seizures Prematurely Unsilence Auditory Synapses to Disrupt Thalamocortical Critical Period Plasticity. Cell Rep. 23, 2533-2540. doi: 10.1016/j.celrep.2018.04.108 (2018).