Prionitautien kohdalla todellisuus kuulostaa miltei fiktiolta. Prionitauti voi syntyä sattumanvaraisesti kenessä tahansa ja milloin tahansa. Tauti leviää kannibalismin välityksellä, johtaa väistämättömästi aivojen terminaaliseen rappeutumiseen, eikä siihen ei ole olemassa parannuskeinoa. Mistä ihmeestä on kyse? Prioni (proteinaceous infectious particle) on rakenteellisesti poikkeava versio solun normaalisti tuottamasta PrP-proteiinista. PrP on solukalvolle ankkuroitu proteiini, joka ilmentyy erityisen voimakkaasti aivojen hermosoluissa. Sen normaali tehtävä liittyy solukalvoliikenteen säätelyyn, joskaan ei ole edelleenkään täysin selvää mitä selkärankaisissa eliöissä ilmentyvä PrP tarkalleen ottaen tekee. Kaikilla solun proteiineilla on mahdollisuus laskostua väärin, mutta PrP:n kohdalla väärinlaskostuminen voi olla kohtalokas. Normaalisti α-kierteinen PrP voi väärin laskostuessaan omaksua β-levymäisen rakenteen PrPSC:ksi kutsutuksi prioniksi. Prionimudossa yksittäiset PrPSC proteiinit tarttuvat toisiinsa ja alkavat muodostaa järjestäytyneitä säikeitä. Näitä säiemäisiä proteiinikertymiä kutsutaan amyloidiksi, joka on tuttu laskostumismuutos monien proteiinien kertymäsairauksien taustalla. Kohdatessaan normaalisti laskostuneen α-kierteisen PrPC proteiinin, prionimuodossa oleva PrPSC kykenee vielä huonosti tunnetun mekanismin kautta muuttamaan tämän ”terveen” proteiinin PrPSC prionimuotoon, joka on energeettisesti edullisempi laskos. Näin solutoksinen PrPSC laskostumismuutos alkaa monistumaan solun sisällä ja johtaa PrPSC proteiinista muodostuvien kertymien syntyyn.
Kuva 1. Prionin synty ja monistuminen. PrP proteiini voi spontaanisti laskostua virheellisesti PrPSC prionimuotoon. Tämä on ilmeisen harvinainen, mutta poikkeuksellisen ongelmallinen ilmiö, sillä prionimuotoinen PrPSCkykenee muuntamaan normaaleja PrPCproteiineja prionimuotoon. Tästä seuraa väärinlaskostuneen muodon monistuminen soluissa, joka johtaa säiemäisten amyloidikertymien muodostumiseen.
Väärin laskostuneet PrPSC partikkelit kykenevät siirtymään myös soluista toiseen, jolloin tauti alkaa leviämään kudoksessa. Prioni häiritsee erityisesti hermosolujen välisten synapsien toimintaa, mistä seuraa etenevä aivojen rappeutuminen. Prionitaudin oireet ilmenevät tyypillisesti häiriöinä käyttäytymisessä, kognitiivisissa toiminnoissa ja liikkeissä. Ihmisissä esiintyviin prionitauteihin kuuluvat Creutzfeldt–Jakobin tauti (CJD), kuru, Gerstmann–Sträussler–Scheinkerin tauti ja fataali familiaalinen insomnia, jossa prionin vaurioittama talamus estää potilaita lopulta nukahtamasta. Kaikkia näitä tauteja yhdistää PrP-proteiinin väärinlaskostuminen PrPSC:ksi, mutta erilaiset laskostumisvariantit, taustatekijät, altistavat seikat ja joissain tapauksissa mutaatiot PrP proteiinia koodaavassa PRNP geenissä johtavat tosistaan jonkin verran poikkeaviin taudinkuviin. Kokeet ovat osoittaneet, että poistogeeniset hiiret, joilta puuttuu PrP proteiini ovat immuuneja prioni-infektioille. Tästä voidaan päätellä, että nimenomaan PrP proteiinin laskostumismuutos prioniksi (PrPC=> PrPSC) synnyttää solutoksisen ominaisuuden, joka johtaa keskushermoston rappeutumiseen. Solutoksisuuden mekanismia ei tunneta vielä hyvin. Paitsi että PrPSC prionimuunnos on leviämiskykyinen, sen muodostama amyloidirakenne on hyvin vakaa ja kestää proteiinirakenteeksi poikkeuksellisen hyvin mm. korkeita lämpötiloja ja pesuaineita, jotka riittäisivät tuhoamaan yleiset tartuntatauteja aiheuttavat mikrobit. Prionin tuhoamiseen suositellaan käytettäväksi 3 bar:n paineessa suoritettavaa 133-137oC lämpökäsittelyä vähintään 20 minuutin ajan. Juuri tämän kestävyytensä ansiosta prionilaskos voi säilyä pitkiä aikoja myös solujen ulkopuolella.
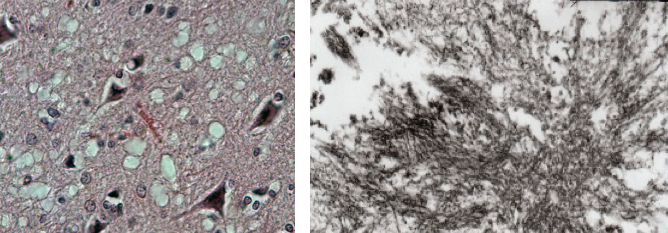
Kuva 2. Prionitaudeille tyypillisiä reikiä kuru-potilaan aivokudosleikkeessä (kuva vasemmalla).
13 000x elektronimikroskooppikuva kurupotilaan PrPSCamyloidikertymästä (kuva oikealla). (Kuvat: Carleton Gajdusek, Viruses 11(3), 232; 2019.).
Näiden seikkojen valossa ei siis ole ihme, että prioneilla on kauhua herättävä maine. Hullun lehmän tauti (bovine spongiform encephalopathy, BSE) on naudoissa esiintyvä prionitauti, joka järkytti eurooppalaisia noin kolmekymmentä vuotta takaperin. Kyseinen epidemia sai alkunsa eläinrehun käytöstä. Nautoja tavattiin ruokkia lajitovereiden teurasjätteistä jauhetulla luu-lihajauholla ja mitä ilmeisimmin rehujauhon joukkoon oli päätynyt prionitautia kantaneen naudan jäännökset. Tämän seurauksena PrPSC prionimuoto päätyi lajitoverien ruuansulatuskanavaan ja sieltä edelleen soluihin infektoiden uusia eläimiä. Pitkän inkubaatioajan takia tämä johti salakavalasti tuhansien nautojen BSE tartuntaan. Ongelma tuli ilmi vasta vuosia myöhemmin ja sairastuneita nautoja päätyi vuosien ajan ihmisten ruokapöytiin. BSE aiheuttaa naudoissa keskushermosto-oireita, jotka ilmenevät muutoksina eläimen käytöksessä. Prionimuunnoksen siirtyminen lajien välillä on hyvin epätodennäköistä ja riippuu aminohapposekvenssien samankaltaisuudesta lajien välillä. Tässä tapauksessa altistus oli kuitenkin niin laajaa, että ikävin pääsi tapahtumaan. Tauti siirtyi naudoista ihmisiin, joissa se aiheutti variantti Creutzfeld-Jacobin (vCJD) taudiksi nimetyn prionitaudin. Yli kaksisataa fataalia vCJD tapausta diagnosoitiin maailmanlaajuisesti vuosien 1996-2013 välillä, joista valtaosa Isossa-Britanniassa. Eläinoikeuksien puolesta taistellut Morrissey julisti lihansyönnin murhaksi vuonna 1985. BSE:n myötä julistus sai uudenlaisen merkityksen. Lihansyönnistä tuli sarjamurha. Vaikka BSE tapaukset ovat sittemmin harvinaistuneet, vaikutukset näkyvät edelleen myös Suomessa. Yli kahden vuoden ikäisiä nautoja testataan edelleen rajoitetusti BSE:n varalta ja Isossa-Britanniassa vuosien 1980-1996 välillä asuneet eivät voi toimia verenluovuttajana Veripalvelussa. Paitsi että prioni on erittäin mielenkiintoinen (pato)biologinen ilmiö, sen taustalle kätkeytyy siis myös merkittäviä yhteiskunnallisia sävyjä.
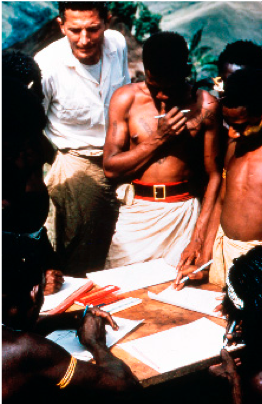
Kuva 3. Vincent Zigas kuvattuna tutkimustyössä fore heimon parissa. (Kuva: Carleton Gajdusek, Viruses 11(3), 232; 2019.).
Se miten prionien jäljille alun perin päästiin, on itsessään varsin mielenkiintoinen tarina. Palataan siis hetkeksi päiväntasaajan eteläpuolelle prionitutkimuksen alkulähteille. Prionien tieteellinen tarina voidaan katsoa alkaneen yhdysvaltalaisen virologin Carleton Gajdusekin tutkimusmatkasta Papua Uuteen-Guineaan, josta hän etsi uusia ihmiskunnalle tuntemattomia sairauksia. Virolaissyntyisen lääkärin Vincent Zigasin johdattamana Gajdusek kiinnostui eteläisen fore-heimon parissa esiintyvästä aivoja rappeuttavasta sairaudesta, kurusta. Fore-heimon hautajaisrituaaleihin kuului menehtyneiden heimojäsenten syöminen ja Gajdusek päätteli kurun (foren kielellä: olla peloissaan, vapista) mahdollisesti liittyvän näihin kannibalistisiin rituaaleihin. Niinpä Gajdusek teki kokeita, joissa hän injektoi kuolleen kurupotilaan muusattua aivokudosta apinoihin. Useamman vuoden inkubaatiojakson jälkeen jotkut näistä apinoista alkoivat saamaan kurun kaltaisia oireita. Muutamaa vuotta myöhemmin Gadjusek osoitti samanlaisen leviämistavan pätevän myös toiseen kurua muistuttavaan hermorappeumasairauteen, Creutzfeldt-Jakobin tautiin. Yhdysvaltalainen eläinpatologi William J. Hadlow osasi yhdistää kurun lampaissa esiintyvään vapinatautiin, skrapiin, niiden taudinkuvissa esiintyvien yhtäläisyyksien perusteella. Gajdusek epäili, että aivorappeuman taustalla olisi jokin poikkeuksellisen hitaasti toimiva virus (ns. ”hidas virus”-hypoteesi). Taudin aiheuttaja ei kuitenkaan ollut virus. Vyyhti alkoi purkautumaan, kun neurologiaan erikoistuva lääkäri Stanley Prusiner vuonna 1972 menetti potilaan Creutzfeldt–Jakobin tautiin. Kyseisen potilaan aivot olivat rappeutuneet hämmästyttävällä nopeudella, ilman merkkejä tulehduksesta tai oireista muissa elimissä. Kokemus sai Prusinerin omistamaan seuraavat vuodet intensiiviselle tutkimustyölle, jossa hän alkoi systemaattisesti selvittämään prionitautien aiheuttajan molekylaarista identiteettiä. Työ kesti kymmenisen vuotta ja sen tulokset löivät tieteellisen yhteisön ällikällä. Prusiner esitti nykyisin hyväksytyn mekanismin, jossa normaali PrPC-proteiini voi muodostaa infektiivisiä PrPSC partikkeleita, jotka johtavat aivojen rappeutumiseen.
Prionit ovat taas aiempaa ajankohtaisempia myös Suomessa. Hirvieläinten näivetystauti (chronic wasting disease, CWD) on aivoja rappeuttava sairaus, joka on levinnyt voimakkaasti Pohjois-Amerikan hirvieläimissä. Tauti leviää etenkin muuli- ja valkohäntäpeuroissa, joissa paikallinen esiintyvyys voi olla jopa yli 25 % kannasta. CWD pääsee leviämään hirvieläinpopulaatioissa ilmeisesti ruumiineritteiden (kuola, virtsa, ulosteet) välityksellä ja ympäristöön päätynyt PrPSC voi rakenteellisen kestävyytensä vuoksi säilyä pitkiä aikoja infektiokykyisenä eläinten elinympäristössä. Pohjoismaiden ensimmäinen CWD-tapaus todettiin vuonna 2016 norjalaisesta tunturipeurasta (Rangifer tarandus tarandus). Tämän diagnoosin seurauksena koko kahdentuhannen eläimen lauma päätettiin lopettaa. Kaikki lopetetut eläimet testattiin ja yhteensä 19 eläimen todettiin kantaneen CWD:tä. Sittemmin pohjoismaisia CWD-löydöksiä on tehty myös isokauriista ja hirvistä. Suomen toistaiseksi ainoa CWD diagnoosi on tehty Kuhmosta vuonna 2018 löytyneestä hirvestä. CWD onkin ollut ruokavirasto Eviran tehovalvonnassa ja vuosien 2016-2019 aikana on tutkittu yhteensä 473 kuollutta hirveä mahdollisen CWD tartunnan varalta. Onko riistan ystävillä syytä huoleen? Toistaiseksi maailmalta ei ole tullut ilmi yhtään tapausta, jossa CWD olisi levinnyt ihmiseen. Olemassa olevan tutkimustiedon valossa leviäminen lajien välillä, esimerkiksi syömällä CWD:ta kantavaa hirvieläintä, on varsin epätodennäköistä, mutta ei kuitenkaan täysin poissuljettua. Apinoilla ja humanisoiduilla hiirillä suoritetuissa eläinkokeissa prionitaudin on raportoitu siirtyneen lajien välillä CWD-infektoituneen lihan- ja aivokudosruokinnan seurauksena. Vaikka ihmistapauksia ei ole tullut vielä ilmi, huoli on kasvamassa etenkin Yhdysvaltain altistuneimmilla alueilla, joissa riistalihan kulutus on suurta. Myös Suomessa on syytä pitää tilanteen kehitystä tarkasti silmällä. Yhdysvalloista opitun tiedon perusteella tiedetään, että leviämistä edistää tiheät kannat ja laumakäytös. Yhtenä pelkona onkin, että hirvieläinten näivetystauti pääsisi leviämään pohjoismaisiin porokantoihin. Siksi on tärkeää pitää tilanteen kehitystä silmällä ja tarvittaessa rajoittaa todennäköisten tartuntaväylien, kuten ruokintapaikkojen ja suolakivien ylläpitoa.
Kuva 4. Tiheät peurakannat edistävät hirvieläinten näivetystaudin leviämistä. Kuvassa muulipeuraemä vasoineen Coloradossa, jossa CWD tartunnat ovat olleet voimakkaassa kasvussa. (Kuva: Juha Saarikangas).
Vaikka tähän saakka käsitellyt asiat liittyvät kaikki PrP proteiiniin, on olemassa lukuisia eri proteiineja, joilla on prionimaisia piirteitä. Esimerkiksi monilla keskeisistä keskushermoston rappeumasairauksista, kuten amyotrofisella lateraaliskleroosilla, Alzheimerin, Parkinsonin, Huntingtonin taudeilla on tiettyjä yhtäläisyyksiä prionitautien kanssa. Näihin sairauksiin liittyy usein tietyn proteiinin haitalinen laskostumismuutos, laskostumismuutoksista johtuvat amyloidimaiset kertymät keskushermostossa sekä haitallisen laskostumismuutoksen kyky levitä solujen välillä prionin kaltaisesti. On myös tärkeää huomata, että prionimaisuus ei myöskään aina ole huono asia. Esimerkiksi nisäkkäiden luonnollinen immuunivaste ja paradoksaalisesti myös muistin toiminta saattavat hyödyntää prionin kaltaista mekanismia toiminnassaan. Prionimainen laskostumismuunnos onkin kontrolloituna soluille varsin tehokas keino lisätä tai muuttaa proteiinin toimintaa paikallisesti. Prionitutkimus on nopeasti etenevä tutkimuskenttä ja siihen liittyviä uusia ilmiöitä ja toimintamekanismeja tunnistetaan nopealla tahdilla. Näiden kuvaaminen auttaa ymmärtämään paitsi elämää ylläpitävien toimintojen monisyisyyttä, mutta mahdollisesti myös selventämään mikä prionitaudeissa menee solutasolla pieleen. Fore heimo soitti alkutahdit prionitutkimukselle. Nyt kuulostaa siltä, että tämän tieteellisen kappaleen pauhu on taas kasvamassa.
Kirjoituksessa esiintyneitä termejä ja lyhenteitä:
- PrPC, normaalimuotoinen PrP proteiini.
- PRPSC, PrP proteiini prionimuodossa.
- Amyloidi, järjestäytynyt säiemäinen proteiinikertymä.
- α-kierre ja β-levy, keskeisiä proteiinien sekundaarirakenteita.
- CJD, Creutzfeldt–Jakobin tauti. Yksi ihmisissä esiintyvistä PrPSC:n aiheuttamista sairauksista.
- BSE, hullun lehmän tauti. Naudoissa esiintyvä PrPSC:n aiheuttama sairaus.
- CWD, hirvieläinten näivetystauti. Hirvieäimissä esiintyvä PrPSC:n aiheuttama sairaus.
Lisää aiheesta:
- Prionitutkimuksen historiaa: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6466359/, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC33918/
- Hullun lehmän tauti Suomessa: https://yle.fi/aihe/artikkeli/2009/04/29/hullun-lehman-tauti
- Hirvieläinten näivetystauti (CWD): https://www.ruokavirasto.fi/viljelijat/elaintenpito/elainten-terveys-ja-elaintaudit/elaintaudit/luonnonvaraiset-elaimet/hirvielainten-naivetystauti-cwd/, https://www.cdc.gov/prions/cwd/index.html
- Prionimainen leviäminen keskushermoston rappeumasairauksissa: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3348110/
Tietoa kirjoittajasta:

Juha Saarikangas toimii apulaisprofessorina Helsingin yliopistossa. Hänen tutkimusryhmänsä tutkii ikääntymisestä johtuvia proteiinien laskostumismuutoksia sekä toiminnallisten proteiinikertymien roolia solujen erilaistumisessa. Sähköposti: juha.saarikangas@helsinki.fi