-
- 1.
-
-
- Väittämä on oikein.
- Kemiallisia reaktioita voi tapahtua ilman entsyymeitä, mutta niiden käynnistymiseen tarvitaan tällöin enemmän aktivaatioenergiaa ja reaktiot käynnistyvät hitaammin.
- Osa entsyymeistä toimii vain, jos kofaktori on liittynyt proteiiniosaan.
- Entsyymi ei tuhoudu reaktion päättyessä, vaan säilyy toimintakykyisenä.
- Joidenkin entsyymien toiminnalle optimaalinen pH on lähellä neutraalia, mutta ei kaikkien.
- Osa entsyymeistä toimii parhaiten yli 55 C-asteen lämpötilassa, mutta esimerkiksi ihmisen entsyymit denaturoituvat.
2.
- Entsyymi
- Aktivaatioenergia
- Substraatti
- Kofaktori
-
-
Avainsana-arkisto: entsyymit
BIO-004: Entsyymit
Tämä oppimateriaali on tuotettu osana Helsingin yliopiston biologian aineenopettajaopintojen Johdatus biologian opiskeluun -kurssia. Perehdyimme entsyymeihin ja kirjoitimme tietotekstin omaa ymmärrystämme syventäen. Suunnittelimme ja toteutimme myös aiheeseen liittyvän opetustuokion lukion biologian Solu ja perinnöllisyys -kurssin (BI3) opiskelijoille.
Tekijät: Katja Leiman, Henna Helén ja Sonja Vanhanen
Kaikki elävät eliöt tarvitsevat entsyymejä toimiakseen (12). Ilman entsyymejä elämälle välttämättömät reaktiot tapahtuisivat liian hitaasti, ja onkin esitetty, että ilman niitä elämä ei olisi mahdollista. (17, s. 29.) Esimerkiksi rubisco helpottaa hiilidioksidin sitomista ilmasta kasvien fotosynteesin pimeäreaktiossa, ja sitä onkin sanottu maailman tärkeimmäksi entsyymiksi (13, s. 19). Myös ihmisen elimistön kemiallisista reaktioista useimmat ovat entsymaattisia (17, s. 29), ja entsyymit ovat äärimmäisen tärkeässä roolissa mm. ruoansulatuksessa (12). Ilman ruuansulatusentsyymejä eläimet ja ihmiset kuolisivat nälkään, sillä entsyymit nopeuttavat ruuan pilkkoutumista solujen käyttöön sopivaan muotoon (7).
Entsyymejä on jokaisessa solussa ja tuhansia erilaisia (1 s. 28; 20, s. 54). Suurin osa niistä toimii solun sisällä, mutta osa eritetään myös solun ulkopuolelle (18). Solun sisäpuolella toimivia entsyymejä ovat esimerkiksi DNA:n kaksoiskierteen avaava entsyymi RNA-polymeraasi sekä lysosomissa ravintoaineita ja nukleiinihappoja pilkkova hydrolaasi (13). Solun ulkopuolelle erittyviä entsyymejä taas ovat esimerkiksi ruuansulatusentsyymit (18).
Kaikki solut tuottavat entsyymejä (18), ja niitä valmistetaan ja eritetään elimistössä tarpeen mukaan (13). Solun tumassa olevat geenit ohjaavat, millaisia entsyymejä ja kuinka paljon solu valmistaa (13).
Useimmat entsyymit ovat proteiineja (25). Solut valmistavat proteiineja aminohapoista proteiinisynteesin avulla. Aminohappojen muodostamat aminohappoketjut kiertyvät tai laskostuvat, vääntyvät mutkille ja liittyvät yhteen pallomaisiksi entsyymeiksi monivaiheisen prosessin seurauksena. (13.) Aminohappojärjestys määrää entsyymin kolmiulotteisen rakenteen (7). Tietyt entsyymit vastaavat oikeanlaisen kolmiulotteisen rakenteen muodostumisesta (19, s. 138). Entsyymin rakenne puolestaan määrittää sen, mitä kemiallista reaktiota entsyymi katalysoi (7). Entsyymi voi myös olla virheellinen, eikä sitä aina valmistu ollenkaan. Esimerkiksi osa ihmisistä saa sienistä vatsavaivoja, koska sienisokeria hajottavaa trehalaasientsyymiä ei kaikilla ihmisillä muodostu. (20, s. 55.)
Entsyymien toiminta
Kukin entsyymi vaikuttaa yleensä vain tietyn molekyylin tai yhdisteen eli substraatin toimintaan (2). Entsyymi-substraattispesifisyydellä tarkoitetaan sitä, että jokaisen reaktion käynnistymiseen vaikuttaa oma entsyymi (13). Kaikilla entsyymeillä on myös oma tietty tehtävänsä. Entsyymejä onkin verrattu työkaluihin: tietyssä tehtävässä toimii paremmin siihen suunniteltu työkalu kuin monitoimityökalu. (15.)
Biologisten reaktioiden käynnistymiseen tarvitaan yleensä runsaasti energiaa (aktivaatioenergia), joten ne alkavat hitaasti. Entsyymit helpottavat reaktioiden käynnistymistä vähentämällä tarvittavan aktivaatioenergiaan määrää ja nopeuttavat reaktioita eli toimivat katalyytteinä. [Kuva 1] Entsyymit eivät kuitenkaan itse kulu reaktiossa. Tästä syystä entsyymeitä tarvitaan vain pieniä määriä, ja niiden voidaan sanoa olevan tehokkaita. (1; 2; 13, s. 19; 20, s. 53-54.)
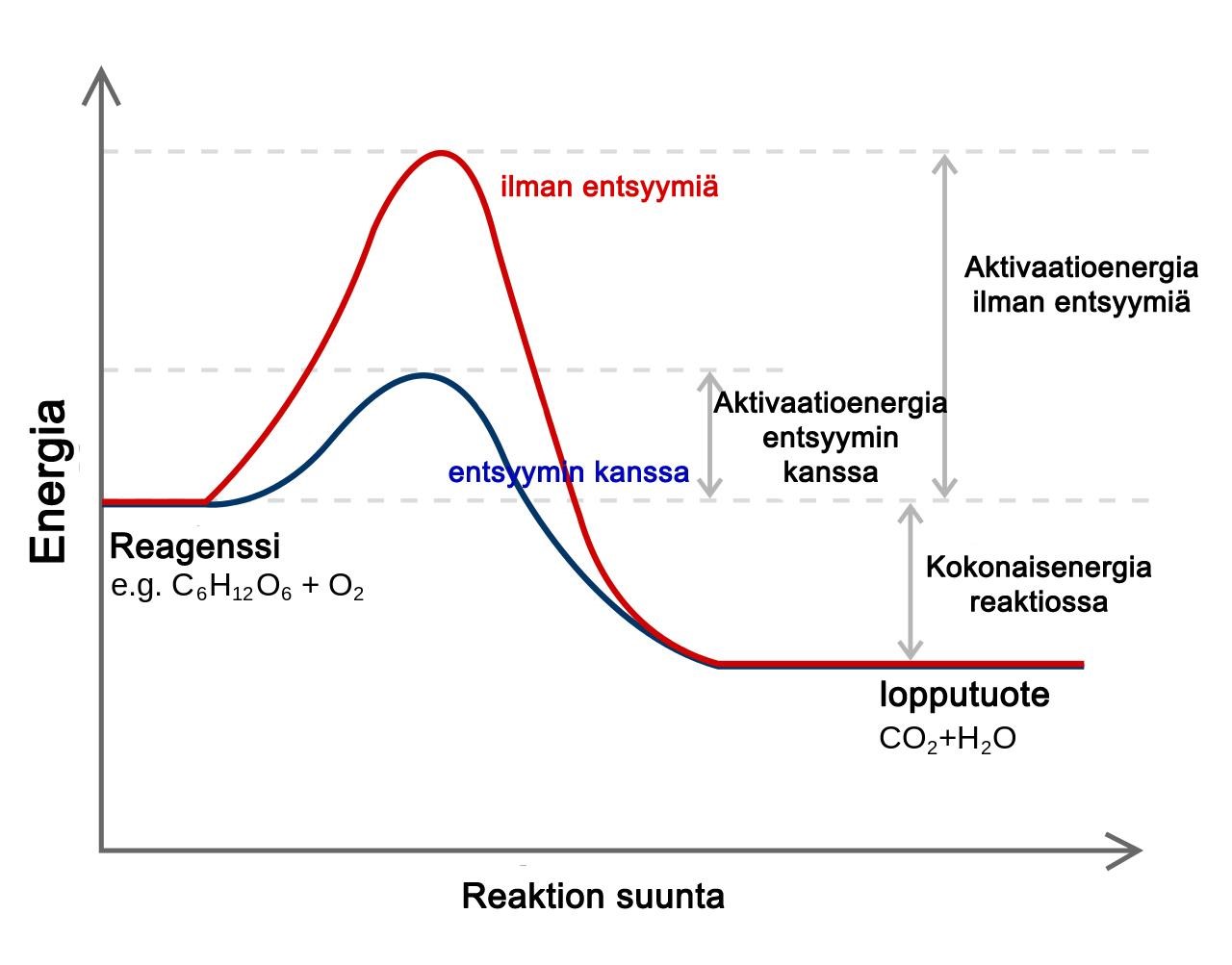
Kuva 1: Aktivaatioenergia soluhengityksessä. Tekijä: Jerry Crimson Mann 2006, muokannut: Henna Helén, Lisenssi: CC, GFDL
Entsyymien rakenne on yleensä kaksiosainen. Suurimman osan entsyymistä muodostaa proteiiniosa (eli apoentsyymi). (13, s. 20.) Osa entsyymeistä kykenee toimimaan vasta, kun niihin on kiinnittynyt erillinen osa, kofaktori (20, s. 54; 21). Kofaktorit voivat olla epäorgaanisia metalli-ioneja tai orgaanisia yhdisteitä, kuten suurikokoisia koentsyymejä, esimerkiksi vitamiineja (13, s. 20; 21; 24). Ne aktivoivat entsyymejä muuttamalla entsyymin aktiivisen alueen eli kiinnittymiskohdan substraatille sopivaksi (13, s. 20; 20, s. 54). [Kuva 2]

Kuva 2: Substraatin sitoutuessa entsyymi muuttaa muotoaan. Heksokinaasientsyymin aktiivinen alue merkitty sinisellä, substraatit (ATP ja 6-hiilinen sokeri) mustalla ja kofaktori (magnesium ioni) keltaisella. Tekijä: Thomas Shafee 2015, Lisenssi: CC
Reaktiossa substraatti kiinnittyy entsyymin aktiiviselle alueelle, syntyy entsyymi-substraatti-kompleksi, ja kemiallinen reaktio käynnistyy (3; 13, s. 20; 17, s. 29). Entsyymi ja substraatti voivat liittyä toisiinsa, koska substraatin sitoutuminen muuttaa entsyymin aktiivisen alueen muotoa (3; 22). Reaktion tuloksena substraatti muuttuu toiseksi aineeksi, lopputuotteeksi. Tällä tavoin substraatti voidaan pilkkoa tai liittää toiseen aineeseen. Reaktion loputtua entsyymi irtoaa lopputuotteesta. (3; 13, s. 20; 17, s. 29.) Entsyymit katalysoivat usein peräkkäisiä reaktioita. Tällöin edellisen reaktion lopputuote on seuraavan reaktion substraatti. (20, s. 54.)
Entsyymit toimivat esimerkiksi solujen aineenvaihdunnassa anabolisten (rakentavien) ja katabolisten (hajottavien) reaktioiden katalyytteinä. Anabolisessa reaktiossa entsyymi katalysoi substraatin rakentumista yksinkertaisemmista yhdisteistä monimutkaisemmiksi yhdisteiksi. Esimerkiksi kasvien pimeäreaktio, jossa glukoosimolekyylit rakentuvat pitkäksi ketjuksi ja muodostavat tärkkelystä. Anaboliset reaktiot sitovat energiaa. Kataboliset reaktiot ovat entsyymien hajottavia reaktioita. Niissä entsyymi katalysoi monimutkaisten yhdisteiden hajottamista yksinkertaisemmiksi yhdisteiksi. Soluhengitys on esimerkki katabolisesta reaktiosta. Siinä glukoosi hajoaa vedeksi ja hiilidioksidiksi ja samalla vapautuu energiaa solun käyttöön. (7, s. 66.) [Kuva 3]

Kuva 3: Entsyymin kiinnittyminen substraattiin ja muutos lopputuotteeksi. Anabolinen ja katabolinen reaktio. Tekijä: Henna Helén 2018, Lisenssi: public domain
Entsyymien toimintaan vaikuttavia tekijöitä
Entsyymien toiminnan tehokkuuteen vaikuttavat kaikki reaktioon osallistuvat ja ulkopuoliset tekijät, mm. entsyymin ja substraatin konsentraatio, happamuus, lämpötila, sekä aktivaattorit ja inhibiittorit. (10; 11; 12 ;13, s. 21; 21; 24) Ne voivat kiihdyttää, hidastaa tai estää entsyymin toiminnan kokonaan (13, s. 21).
Useimmissa eliöissä syntyy soluhengityksen sivutuotteena vetyperoksidia. Se on haitallista soluille, joten siitä pitää päästä nopeasti eroon. (12.) Tästä syystä soluissa on katalaasientsyymiä, joka hajottaa vetyperoksidia vedeksi ja hapeksi (12; 13, s.22). Hajotettavan vetyperoksidisubstraatin määrä eli konsentraatio vaikuttaa reaktion voimakkuuteen, joka on alkuvaiheessa nopea ja tuottaa paljon happea, mutta pysähtyy vähitellen substraatin vähentyessä. (13, s. 22.)
Kukin entsyymi toimii parhaiten juuri sille optimaalisissa olosuhteissa. Entsyymin toiminta vaikeutuu tai estyy epäsopivassa lämpötilassa tai pH:ssa. Useimmat solujen entsyymit toimivat parhaiten pH-neutraalissa ympäristössä, kuten esimerkiksi syljessä tärkkelystä pilkkova amylaasientsyymi. Ruuansulatuskanavan eri osissa esiintyy entsyymejä, jotka toimivat parhaiten happamissa tai emäksisissä olosuhteissa. Mahalaukussa happamassa nesteessä (pH 2) maharauhasen erittämä pepsiini pilkkoo ruuan proteiineja peptideiksi ja aminohapoiksi. Ruokasulan edettyä pohjukaissuoleen proteiinien pilkkomista jatkaa haiman erittämä trypsiini, jonka ihanteellinen pH on 8. Haima erittää monia ruoka-aineita hajottavia entsyymejä. (10; 11; 12; 17) [Kuva 4]
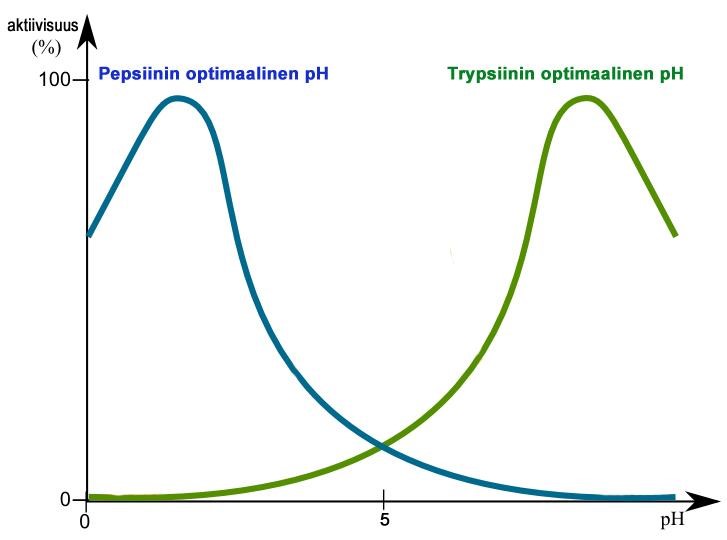
Kuva 4: Happamuuden vaikutus pepsiini- ja trypsiinientsyymien toimintaan. Tekijä: Gal M. 2007, muokannut: Henna Helén, Lisenssi: CC, GFDL
Esimerkiksi liian kuumassa ympäristössä entsyymi denaturoituu eli menettää kolmiulotteisen rakenteensa, jolloin se ei ole enää toimintakykyinen. Kuumennuksessa proteiinin kolmiulotteista rakennetta ylläpitävät rikkisidokset katkeavat ja vetysidokset järjestäytyvät uudelleen (eli rakenne muuttuu). Proteiinien denaturoitumisen korkeassa lämpötilassa voi huomata esimerkiksi ruuan valmistuksessa. Kananmunan paistaminen tai keittäminen saa munanvalkuaisen proteiinimolekyylit liittymään toisiinsa ja sitomaan vettä, jolloin valkuaisen koostumus muuttuu sakeaksi. Ihmisen entsyymit toimivat parhaiten +37 ºC:n lämpötilassa, ja yli 42ºc:n kuume johtaa denaturoitumisen vuoksi kuolemaan. Kuumissa lähteistä elävien bakteerien ja arkeonien entsyymit puolestaan toimivat parhaiten lähes +80ºC:ssa. Alhaisessa lämpötilassa entsyymien toiminta hidastuu, mutta ei lopu kokonaan edes pakkasasteiden puolella. Siksi pakastetut ruoka-aineet eivät säily ikuisesti. (7; 13, s. 22; 14.)
Entsyymien toiminnan säätely
Tietyt kemialliset aineet aktivoivat tai ehkäisevät entsyymien toimintaa. Solut myös tuottavat itse näitä aktivaattoreita ja inhibiittoreita. Entsyymien toimintaa kiihdyttäviä aineita kutsutaan aktivaattoreiksi. Aktivaattoreita ovat esimerkiksi monet kofaktorit ja koentsyymit. (24.)
Inhibiittorit ovat aineita, jotka estävät entsyymin aktiivisuutta (7). Inhibiittorit voivat estää entsyymin toiminnan tilapäisesti tai pysyvästi (13, s. 21). Ne voivat olla joko soluille haitallisia vierasaineita tai solun omia luontaisia inhibiittoreita. Esimerkiksi entsyymireaktion lopputuote voi toimia luontaisena inhibiittorina estäen entsyymin toiminnan silloin, kun lopputuotetta on tuotettu riittävästi. Näin solun sisäiset kemialliset reaktiot pysyvät tasapainossa. (7.)
Inhibiittori voi estää entsyymin toiminnan sitoutumalla itse entsyymin aktiiviselle alueelle (kilpaileva inhibitio) tai muuttamalla entsyymimolekyylin muotoa (ei-kilpaileva inhibitio). Kilpaileva inhibiittori sitoutuu entsyymin aktiiviselle alueelle, jolloin substraatti ei voi sitoutua siihen. (7.) [Kuva 5]

Kuva 5: Kilpaileva inhibitio. Tekijä: Jerry Crimson Mann 2006, muokkaus: Henna Helén, lisenssi: public domain
Ei-kilpaileva inhibiittori sitoutuu erilliseen sitoutumiskohtaan (allosteerinen kohta) entsyymissä. Inhibiittorin sitoutuminen aiheuttaa rakenteellisen muutoksen entsyymissä, mikä estää substraatin sitoutumisen. (7) [Kuva 6] Tätä kutsutaan entsyymin allosteeriseksi säätelyksi ja se voi olla entsyymiin sitoutuneesta molekyylistä riippuen joko inhiboiva tai aktivoiva reaktio (23). Allosteeriset säätelijät ovat lupaavia entsyymien aktiivisuuteen vaikuttavia lääkeaineita, koska ne ovat hyvin spesifisiä, toisin kuin aktiiviseen keskukseen sitoutuvat inhibiittorit (16).
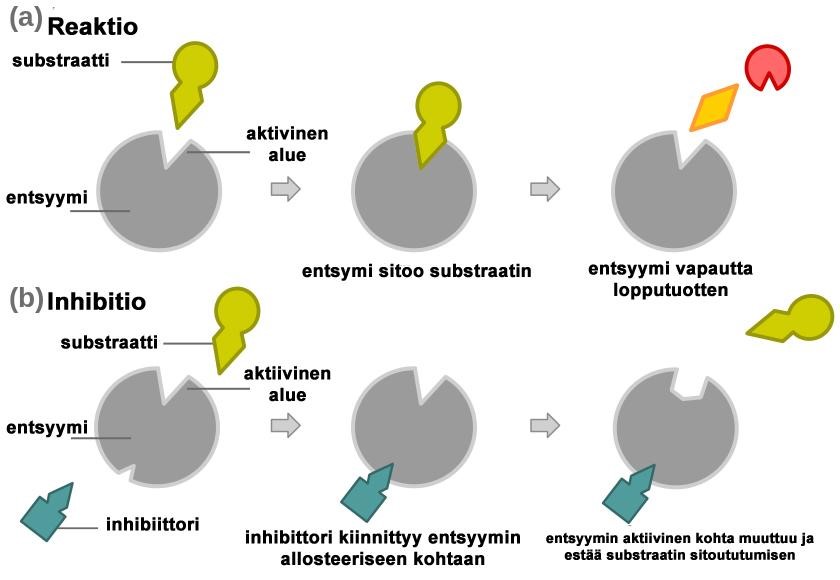
Kuva 6: Ei kilpaileva inhibitio, allosteerinen säätely. Tekijä: Jerry Crimson Mann 2009, muokannut: Henna Helén, Lisenssi: public domain
Esimerkiksi monet lääkeaineet vaikuttavat entsyymien inhibitioreaktioihin. Kivun hoito perustuu nykyisin pääasiassa tulehduskipulääkkeisiin, joiden vaikutusmekanismina on COX-entsyymien toiminnan ja prostanoidien synteesin esto. (6.) Osa antibiooteista toimii bakteerien inhibiittoreina kiinnittymällä niiden aineenvaihdunnassa toimivien entsyymien aktiiviseen kohtaan (kilpaileva inhibitio) (7). Myös monet myrkyt vaikuttavat inhiboimalla entsyymejä. Esimerkiksi syanidi sitoutuu mitokondrioiden sytokromi-c-oksidaasi-entsyymiin, denaturoi sen ja katkaisee soluhengityksen elektroninsiirtoketjun, joka johtaa solun energiantuotannon loppumiseen (8; 9).
Entsyymien hyödyntäminen
Entsyymejä hyödynnetään monissa arkielämän tuotteissa ja niiden valmistuksessa. Esimerkiksi juuston valmistuksessa maito juoksutetaan kymosiinientsyymin avulla, ja vähälaktoosisista maitotuotteista laktoosia on pilkottu laktaasientsyymin avulla. (12.) Hammastahnaan ja purukumiin voidaan lisätä entsyymejä pahanhajuista hengitystä ehkäisemään, ja hiusväriin värin kiinnittymistä helpottamaan (19, s. 374-375). Monet pyykinpesuaineet sisältävät proteaasi-, amylaasi- ja lipaasientsyymejä, jotka hajottavat likatahrojen proteiineja, tärkkelystä ja lipidejä. Entsyymit toimivat hyvin eri lämpötiloissa, ja erilaisten entsyymien ansiosta voidaan käyttää alhaisempaa pesulämpötilaa sekä lyhyempää pesuohjelmaa. Kaikissa pesuaineissa ei kuitenkaan ole entsyymejä. Esimerkiksi villa ja silkki ovat proteiinipitoisia, ja proteaaseja sisältävä pesuaine harjoittaisi niiden kuitujen rakenteen. (12.)
Suuri osa kaupallisesti saatavilla olevista entsyymeistä on peräisin ja tuotetaan sienissä. Useimmat niistä on tarkoitettu elintarvike- ja pesuaineteollisuuden käyttöön. (19, s. 374.) Sienten kykyä hajottaa luonnonpolymeereja solunulkoisten entsyymien avulla hyödynnetään kasvibiomassojen muokkauksessa, esimerkiksi muovien raaka-aineena ja polttoaineena käytettävän etanolin valmistuksessa (19, s. 372, 379-381).
Entsyymejä hyödynnetään myös paperin valmistuksessa ja puuvillakankaiden käsittelyssä, sekä tekstiiliteollisuuden tuottamien väriaineiden puhdistuksessa jätevesistä. (19, s. 373-375, 382.) Parhaillaan tutkitaan sienten entsyymejä lääkkeiden kehitystyössä, pilaantuneen maan kunnostuksessa, sekä entsyymien vaikutusta jätevesien ympäristöä uhkaaviin yhdisteisiin ja lääkejäämiin (19, s. 374, 376, 382-383).
Käsitteet
Aktiivinen alue, aktiivinen keskus – substraatin (ja kilpailevan inhibiittorin) sitoutumiskohta entsyymissä.
Aktivaatioenergia – reaktion käynnistymiseen vaadittavan energian määrä.
Aktivaattori – entsyymin toimintaa aktivoiva aine (engl. activate)
Allosteerinen kohta – ei-kilpailevan inhibiittorin sitoutumiskohta entsyymissä.
Anabolia – rakentava reaktio, jossa kemiallista energiaa sitoutuu orgaaniseen yhdisteeseen.
Denaturoituminen – Proteiinien rakenteen muutos, jossa toimintakyky häviää. Tämä voi tapahtua esimerkiksi liian lämpimässä, happamassa, tai suolapitoisessa ympäristössä.
Entsyymi-substraatti-kompleksi, ES-kompleksi – entsyymin ja substraatin muodostama kokonaisuus.
Entsyymi-substraattispesifisyys – Kukin entsyymi vaikuttaa tietyn substraatin toimintaan.
Inhibiittori – entsyymin toimintaa ehkäisevä aine (engl. inhibit)
Katabolia – kemiallista energiaa vapauttava, hajottava reaktio.
Katalyytti – aktivaatioenergiaa pienentävä, kemiallista reaktiota nopeuttava aine.
Kofaktori – Aine jota entsyymi tarvitsee, mutta joka ei osallistu reaktioon. Kofaktori muodostaa toimivan entsyymin yhdessä proteiiniosan kanssa.
Koentsyymi – suurikokoinen orgaaninen kofaktori, esimerkiksi vitamiini.
Lopputuote – Substraatista muodostuva, entsymaattisen reaktion päättyessä valmistuva aine.
Proteiiniosa eli apoentsyymi – Muodostaa suurimman osan entsyymistä.
Substraatti – Molekyyli tai yhdiste, jota rakennetaan tai hajotetaan entsymaattisessa reaktiossa. Kiinnittyy entsyymin aktiiviselle alueelle.
Tehtävät
- Mitkä seuraavista väittämistä ovat virheellisiä. Miksi? Korjaa virheelliset väittämät.
- Kaikki solut tarvitsevat entsyymejä toimiakseen.
- Kemiallisia reaktioita ei voi tapahtua ilman entsyymejä.
- Entsyymit toimivat vain, jos kofaktori on liittynyt proteiiniosaan.
- Entsyymi tuhoutuu reaktion päättyessä.
- Entsyymien toiminnalle optimaalinen pH on lähellä neutraalia.
- Entsyymit toimivat parhaiten yli 55 C-asteen lämpötilassa.
- Mihin käsitteeseen selitys liittyy?
- Aktivaatioenergiaa pienentävä ja kemiallista reaktiota nopeuttava aine, yleensä proteiini.
- Reaktion käynnistymiseen vaadittavan energian määrä.
- Entsyymin aktiiviselle alueelle kiinnittyvä molekyyli tai yhdiste, jota rakennetaan tai hajotetaan entsymaattisessa reaktiossa.
- Muodostaa toimivan entsyymin yhdessä proteiiniosan kanssa.
Materiaalia oppitunnille
Juuston valmistus, opiskelijoiden työohje
Juuston valmistus, opettajan työohje